鼻咽癌(NPC)发生于鼻咽部,是一种起源于鼻咽上皮细胞的恶性肿瘤,其发生主要与遗传因素、EB病毒感染和环境因素有关。放眼全球,NPC的发病率极不均衡,具有明显的区域聚集性和种族偏好性,多发于东亚和东南亚,尤其是我国南方[1]。然而,NPC的具体病因和发病机制尚不清楚,仍待进一步研究。
环状RNA(circRNA)具有种类丰富、结构稳定、序列保守以及组织特异性表达等特点,且在肿瘤发生过程中发挥重要的调节作用。有学者利用高通量测序和生物信息学技术,在NPC细胞中鉴定出了数个独特的circRNA,发现它们在NPC细胞和正常细胞之间具有显著差异表达,表明circRNA可以作为潜在的临床诊断和预后指标[2]。然而,circRNA在NPC中的潜在机制仍然未知。
2023年5月12日,中南大学基础医学院肿瘤研究所向波研究员团队在Nature集团旗下期刊Cell Death & Differentiation发表文章Circular RNA circRILPL1 promotes nasopharyngeal carcinoma malignant progression by activating the Hippo-YAP signaling pathway。作者在鼻咽癌细胞中鉴定到一个新的环状RNA——circRILPL1。它可以结合并激活ROCK1以抑制LATS1激酶,从而抑制LATS1对YAP的磷酸化过程,并且增强YAP活性。同时,circRILPL1通过增强YAP与核转运受体IPO7之间的相互作用,促进YAP易位进入细胞核。在细胞核中,活化的YAP会促进CAPN2和PXN的转录表达。此外,circRILPL1在体内外均能促进NPC的增殖和转移。文章解析了环状RNA在鼻咽癌细胞中的信号传导作用,揭示环状RNA circRILPL1通过激活Hippo-YAP信号通路调控鼻咽癌的发病机制。

circRILPL1在鼻咽癌组织中高表达,并与鼻咽癌患者预后不良相关
首先,作者在GEO数据库中搜索并分析NPC的RNA-seq数据,确定了30个在NPC组织中高表达的circRNA,其中circRILPL1为首次发现。qRT-PCR和ISH结果显示,circRILPL1在NPC中的表达量显著高于非癌性鼻咽上皮组织组别。此外,作者分析Kaplan-Meier曲线发现,circRILPL1高表达对NPC患者预后差,而circRILPL1低表达的NPC患者预后较好。接着,通过核质分离定量实验和FISH实验分析,发现circRILPL1在细胞质和细胞核中均有分布。综上表明,circRILPL1是一个在NPC中高表达的新环状RNA,可能在NPC的肿瘤发生中发挥作用。
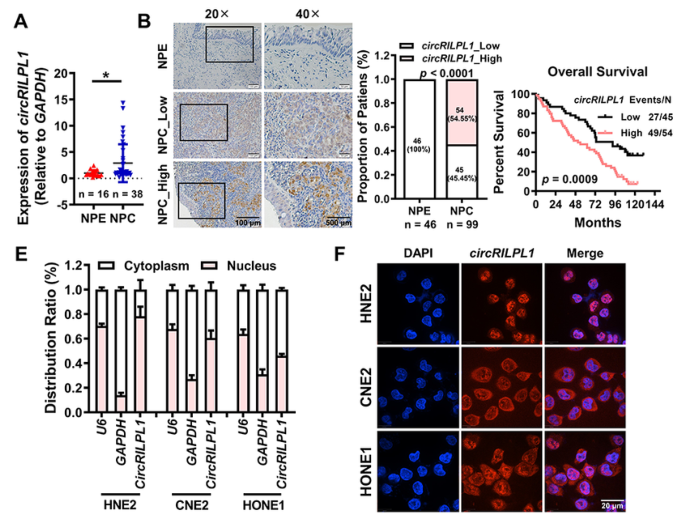
图1 circRILPL1在NPC中的表达水平和细胞定位
circRILPL1在体外和体内均促进NPC细胞的增殖和迁移
作者通过划痕和transwell实验分析发现,过表达circRILPL1可以显著增强NPC细胞的迁移和侵袭。此外,MTT和克隆形成实验表明,过表达circRILPL1会促进NPC细胞的增殖,而敲低circRILPL1后获得了相反的结果。结合皮下肿瘤模型和IHC数据发现,与对照组相比,circRILPL1过表达组的肿瘤体积和重量显著增加且Ki67的表达量较高,而circRILPL1敲低组的结果相反,表明circRILPL1促进了小鼠NPC细胞的生长。综合尾静脉注射肺转移模型和裸鼠脚垫淋巴转移模型实验数据发现,与对照组相比,过表达circRILPL1会促进小鼠NPC细胞发生肺转移和腹股沟淋巴结转移,而circRILPL1敲低组的肿瘤细胞转移较少。综上表明,过表达circRILPL1在体外和体内均促进了NPC细胞的增殖、迁移和侵袭。
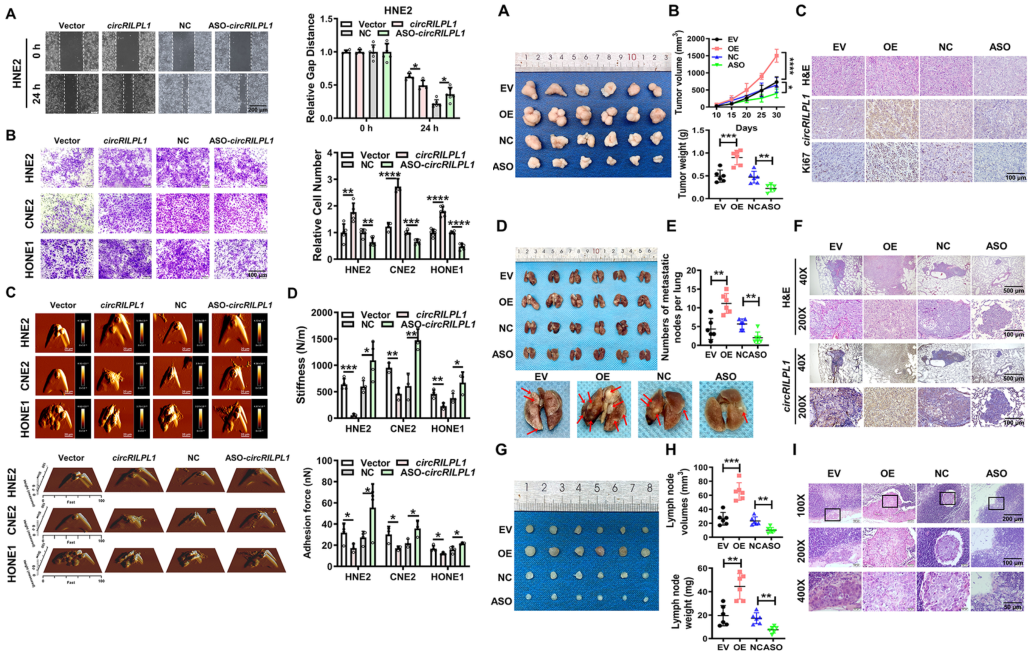
图2 circRILPL1在体内和体外促进NPC细胞的增殖、迁移和侵袭
circRILPL1激活Hippo-YAP信号通路
作者利用LC-MS/MS技术对过表达circRILPL1的NPC细胞系进行蛋白质组学分析,结果显示Hippo信号通路中有11种蛋白质被富集。通过WB实验结果表明,Hippo信号通路中的核心蛋白YAP(Ser127和Ser397)和LATS1的磷酸化会因circRILPL1的过表达或敲低而受到调节,而MST1没有显著变化。荧光素酶报告基因结果显示,过表达circRILPL1显著增强了YAP的转录活性,而敲低circRILPL1则产生了相反的结果。此外,作者通过划痕实验和transwell分析发现,过表达YAP可以逆转circRILPL1敲低对NPC细胞迁移和侵袭的抑制作用。而且,MTT和克隆形成测定结果显示,过表达YAP逆转了circRILPL1敲低对NPC细胞增殖的抑制作用。总之,circRILPL1在NPC细胞中的功能依赖于YAP信号通路的激活。
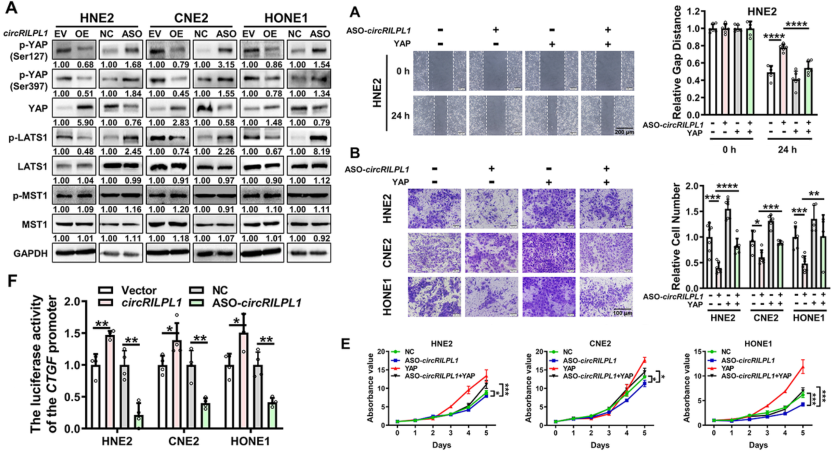
图3 circRILPL1激活Hippo-YAP信号通路
circRILPL1与ROCK1结合,抑制LATS1-YAP激酶级联反应
为了探索circRILPL1调节Hippo-YAP信号通路的机制,作者通过质谱法鉴定RNA pull-down产物,发现circRILPL1不直接结合LATS1或YAP,但与ROCK1结合。接着,作者用RNA pull-down和RIP实验,结合IF-FISH的共定位结果,证实了circRILPL1与ROCK1互作。WB结果显示,在过表达circRILPL1的NPC细胞中利用siRNA敲低ROCK1的表达水平,显著抑制了LATS1的去磷酸化,从而抑制了YAP去磷酸化并导致YAP蛋白水平显著降低,表明circRILPL1与ROCK1互作在LATS1-YAP激酶级联反应中发挥重要作用。
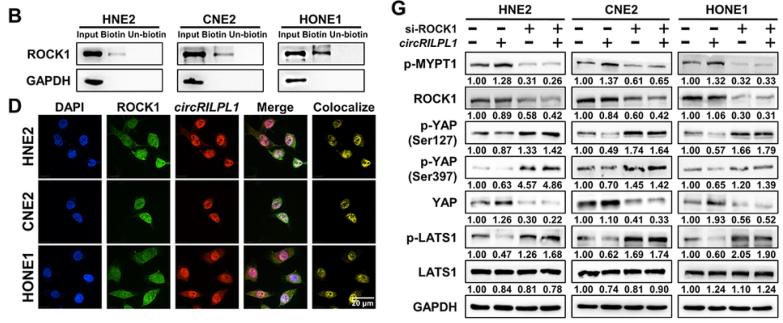
图4 circRILPL1与ROCK1互作来抑制LATS1-YAP激酶级联反应
circRILPL1与IPO7结合,促进YAP蛋白发生核易位
作者在与circRILPL1结合的pull-down产物中发现了一种核转运受体IPO7,并且用RNA pull-down、RIP和IF-FISH证实了circRILPL1和IPO7之间存在相互作用。通过核质分离定量分析,结合免疫荧光结果,发现过表达circRILPL1能诱导IPO7进入细胞核,而敲低circRILPL1则减少了IPO7入核。IP和免疫荧光结果显示,过表达circRILPL1使IPO7和YAP之间的结合显著增强。综上表明,circRILPL1介导了IPO7和YAP之间的结合。WB结果显示,敲低IPO7会阻碍circRILPL1诱导YAP从细胞质易位到细胞核,并抑制YAP转录活性,表明circRILPL1在一定程度上依赖于IPO7蛋白诱导YAP核易位。
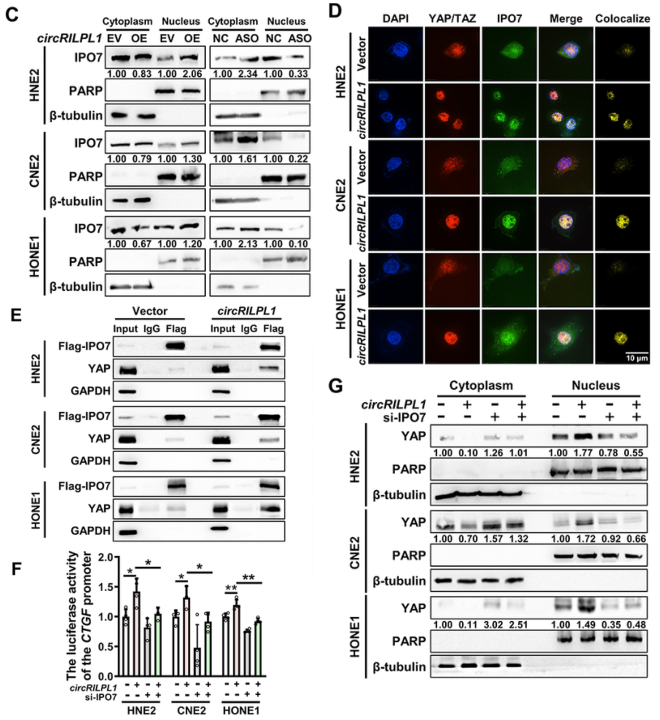
图5 circRILPL1与IPO7互作来促进YAP核易位
circRILPL1-YAP信号传导促进CAPN2和PXN的转录
作者分析circRILPL1过表达后的差异表达基因,发现circRILPL1-YAP信号传导通路能激活在细胞迁移和侵袭中起重要作用的基因CAPN2和PXN。此外,qRT-PCR和WB结果证实了circRILPL1可以使NPC细胞中CAPN2和PXN的mRNA表达和蛋白水平上调。过表达YAP促进了CAPN2和PXN的转录,而敲低YAP抑制其转录。而且,过表达YAP能逆转由circRILPL1敲低引起的CAPN2和PXN转录水平降低。ChIP实验结果显示,过表达circRILPL1促使YAP富集在CAPN2和PXN启动子区域。综上表明,circRILPL1通过激活YAP来促进CAPN2和PXN的转录。
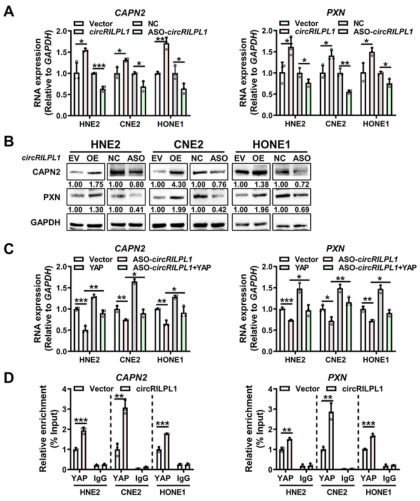
图6 circRILPL1-YAP信号传导促进CAPN2和PXN的转录
总结:
circRILPL1通过结合并激活ROCK1来抑制LATS1激酶,从而抑制YAP的磷酸化;circRILPL1与核转运受体IPO7互作,使YAP与IPO7结合,从而增强YAP核易位;而YAP可以激活CAPN2和PXN的转录表达。总的来说,circRILPL1通过结合ROCK1和IPO7,协同调节YAP的激活及其核易位,诱导NPC细胞发生增殖、迁移和侵袭,在鼻咽癌肿瘤发生中发挥关键的致癌作用。
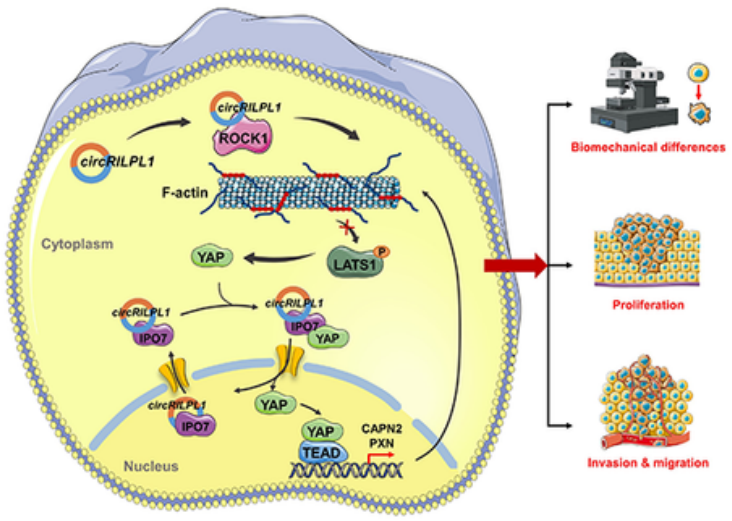
图7 circRILPL1在NPC细胞中介导的分子机制
参考文献:
[1] Chen, Y.P., et al., Nasopharyngeal carcinoma. Lancet, 2019. 394(10192): p. 64-80.
[2] Zhou, D.N., et al., Integrated analysis of transcriptome profiling predicts potential lncRNA and
circRNA targets in human nasopharyngeal carcinoma. Oncol Lett, 2020. 19(4): p. 3123-3136.
原文链接:
https://doi.org/10.1038/s41418-023-01171-8
.png)
