RNA-DNA杂交在哺乳动物基因组中很常见,包括在DNA复制和转录过程中形成的杂交。然而,当RNA碱基对与其同源的DNA位点配对时,可形成三链核酸结构的R-loop,从而取代单链DNA环(ssDNA)。这种R-loop介导的DNA突变很广泛,表现为碱基切除修复引起的双链DNA断裂(DSBs),介导基因组失衡,可在活化B细胞的免疫球蛋白类开关重组(CSR)中发挥作用。可以想象,异常的R-loop可以诱发致癌突变,引起癌症发生。
在所有癌症类型中,急性白血病突变率最低,平均每兆酶少于0.5个突变。H3K4组蛋白甲基转移酶混合谱系白血病(MLL,也称为KMT2A)基因染色体易位在急性白血病患者中约占5%-10%,但在婴儿白血病患者中占比高达70%以上。这些易位伴侣基因谱,被称为MLL重组体。大多数MLL易位定位于8.3kb的断点簇区(bcr),包括MLL的内含子5-12及其伴侣基因内含子的共同位点。但是易位产生的机制以及它如何与伴侣基因融合仍有待充分阐明,了解这些MLL重组对于预防白血病至关重要。
2023年6月,弗林德斯癌症创新中心的Simon Conn教授和Vanessa Conn博士团队在世界顶级癌症期刊之一的Cancer Cell(IF=38.585)上发表重磅文章Circular RNAs drive oncogenic chromosomal translocations within the MLL recombinome in leukemia。作者发现circRNA(circRNAs)在MLL重组体中富集,可结合DNA并在其同源位点形成circRNA-DNA杂交体(circR-loop)。这些circR-loop促进转录暂停、蛋白酶体抑制、染色质重组和DNA断裂。重要的是,在小鼠白血病异种移植模型中过表达circRNA会导致基因组的共定位(MLL重组体的染色体易位),从而诱发疾病。这些研究结果解析了白血病中内源性RNA染色体易位机制。
circR-loop在人类基因组中普遍存在,在MLL重组体内富集
为了评估circRNAs在人类细胞全基因组中形成R-loop的能力,作者对HEK293T细胞进行了DRIP-seq,确定了20,467个离散的R-loop。通过将R-loop与相匹配的核分数circRNA测序(circRNA-seq)进行交叉比对(蓝色条),在核部分鉴定出11035个独特的circRNA(细胞质部分鉴定出60009个circRNA),其中1279个与R-loop峰重叠,以下称为circR-loop(紫色条)。circR-loop组约占所有检测到的R-loop的6%。
在MLL重组体中,作者发现含circRNA的基因在HEK293T细胞中高度富集(61个表达基因中56个含circRNA的基因=91.8%)、急性早幼粒细胞白血病细胞(71.4%)、ALL(60.5%)和非白血病mesHMLE细胞(80%)。


图1 circR-loop在与白血病和染色体不稳定相关的基因内富集
circMLL形成R-loop的量化和可视化以及诱发转录暂停
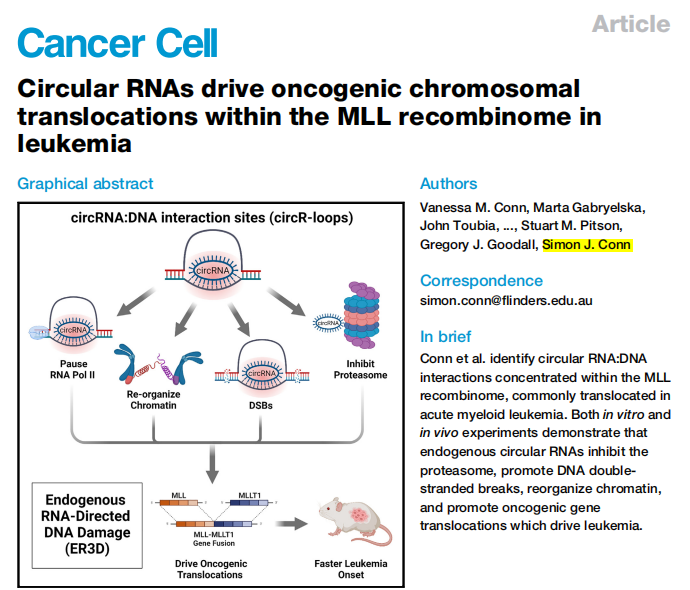
为了评估MLL重组体下circR-loop导致染色体易位的可行性,作者在HEK293T细胞中过表达完全包含在MLL中的circRNAs(circMLL(9,10)和circMLL(12))及其共同伴侣基因MLLT1(circMLLT1(2)),并进行了DRIP-seq(特异识别DNA)。对于所有circRNA,在MLL和MLLT1的同源外显子上都可以看到DRIP峰。在杂交程度增加的情况下使用R-loop特异性S9.6抗体进行点印迹定量,发现circRNA在低杂交状态下形成R-loop的能力就强于线性RNA。这一结果证明了circRNA对同源DNA具有很高的亲和力。
为了直观地验证circR-loop的形成,作者使用单个RNA探针靶向circMLL的后剪接连接(9,10)和DNA探针靶向MLL基因组DNA位点,进行了三维RNA-DNA荧光原位杂交(3D RNA/DNA-FISH)。在3D RNA/DNA-FISH之前,用空载体(pcDNA3.1)或circMLL(9,10)过表达构建体转染HEK293T细胞。在对照细胞系中没有发现信号;在circMLL(9,10)过表达细胞系中,细胞核DAPI染色发现一到两个离散信号。circMLL(9,10)信号总是与MLL gDNA基因信号共定位,表明circMLL(9,10)与其同源基因组位点在物理上、核上共定位。
通过转录物分析,将对照和MLLr白血病进行分层,qRT-PCR来量化circRNA。与对照组相比,MLLr白血病患者样本中circRNA的丰度高出100倍以上。为了研究circR-loop是否促进转录暂停,作者从已发表的HEK293T NET-seq数据中检测了RNAPII占用率,该分析发现,与同一基因内的其他外显子相比,RNAPII在circR-loop附近(包括上游和下游内含子)富集,但在500个最丰富的circRNA中,和在与先前公布的HEK293T细胞的circRNA数据集相对应的部位,则没有这种情况。这表明RNAPII暂停在circR-loop附近富集,并不是circRNA转录的普遍特征。
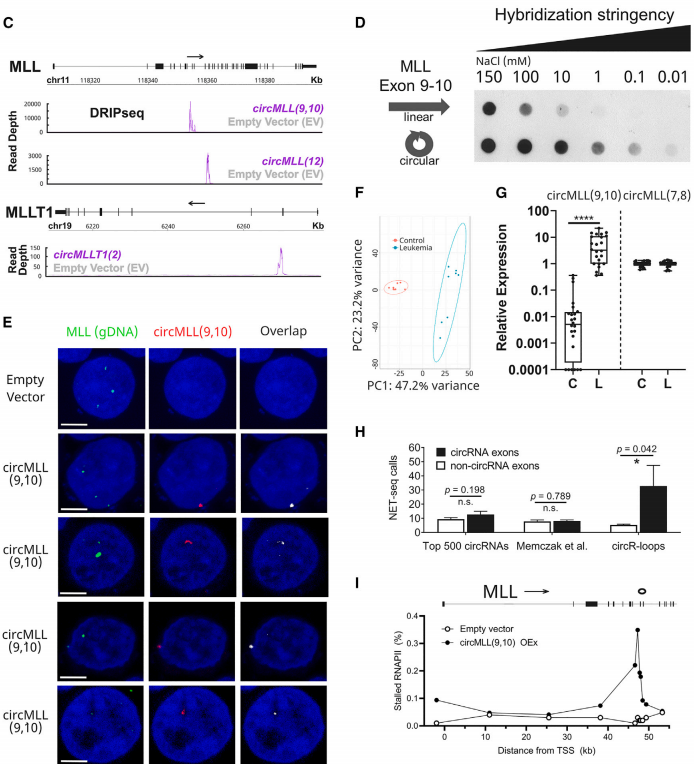
图2 circRNA与同源DNA位点形成R-loop,促进转录暂停
circR-loop引起双链DNA断裂(DSBs)
为评估circR-loop是否与染色体易位相关,作者将circR-loop与全基因组的DSBs相关联。利用来自野生型HEK293T细胞公开的BLESS(断裂标记、链亲和素富集和下一代测序)数据,发现与丰度最高、核定位的circRNAs相比,靠近circR-loop的DSBs的发生率增加。
接着,作者通过单独和联合表达circMLL(9,10)和circMLLT1(2)来分析候选circRNAs在其同源基因座上驱动特定DSBs的能力,这两种RNA都形成精确、稳定的circR-loop,在HEK293T细胞中表达FLAG标记的AID或缺乏胞苷脱氨酶结构域(AIDΔ58-94或mutAID)的催化死亡阴性对照AID蛋白。通过执行BLESS的更可扩展的版本(原位断裂标记和测序),作者发现在AID存在的情况下,MLL和MLLT1中circR-loop相邻的内含子中DSBs形成增加,但与mutAID共同表达时或过量表达circSMARCA5(15,16)时,尽管先前在该部位发现了一个circR-loop,但没有明显的DSBs。
作者在circMLL(9,10)(平均病灶/细胞=7.2)瞬时过表达后,观察到核γH2A.X信号的增加,一种已知的DNA损伤标志物,而没有在circSMARCA5(15,16)(平均病灶/细胞=0.2)中观察到。这表明circMLL(9,10)介导的效应不是MLL位点特异性的,而是更广泛地影响基因组。有趣的是,随着circMLL(9,10)的共同表达,MLLT1内含子的DSBs数量增加了10倍,这进一步表明circMLL(9,10)的表达可诱发DSBs。
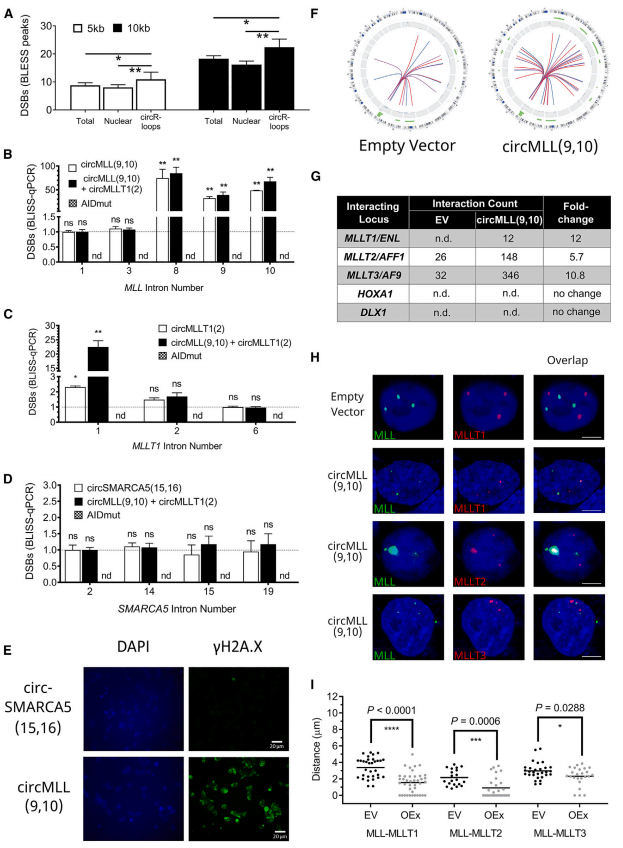
图3 circRNA驱动DSBs并促进MLL重组体中的共定位
circMLL(9,10)与蛋白酶体相互作用并抑制蛋白酶体的成分
为了深入了解circMLL(9,10)暂停RNAPII并在同源和伴侣位点引起DSBs的能力机制,作者进行了circRNA免疫沉淀来分析circMLL(9,10)的蛋白质相互作用。KEGG分析发现蛋白酶体是最丰富的功能类别物。虽然每个蛋白都是较大的26S蛋白酶体的成分,但催化核心亚基20S蛋白酶体的14个亚基中有5个被circMLL(9,10)结合。
作者接着在HEK293T细胞中与circMLL共表达带有FLAG标记的2型蛋白酶体(PSMA2)(9,10),通过RNA免疫沉淀(RIP)后的western blotting成功地富集了PSMA2-FLAG。circMLL(9,10)的qRT-PCR实验表明,PSMA2和circMLL(9,10)之间存在相互作用。
通过慢病毒转染制备稳定细胞系,分析三种主要的蛋白酶体活性(凝乳胰蛋白酶样、胰蛋白酶样和caspase样)。用5mM的环氧霉素(Epoxomicin)作为对照蛋白酶体抑制剂,可显著降低所有蛋白酶的活性。与空载体对照细胞系相比,单独或与circMLLT1(2)联合过量表达circMLL(9,10),导致凝乳胰蛋白酶样活性有统计学意义的下降。然而,单独过表达circMLLT1(2)并不会改变凝乳胰蛋白酶样、胰蛋白酶样或caspase样蛋白酶体的活性。这表明circMLL(9,10)存在时细胞蛋白酶体活性降低。此外作者亦发现,circMLL(9,10)能够直接抑制20S蛋白酶体活性。
 图4 circMLL(9,10)与20S蛋白酶体相互作用并抑制凝乳胰蛋白酶样活性
图4 circMLL(9,10)与20S蛋白酶体相互作用并抑制凝乳胰蛋白酶样活性
circRNAs在体内外驱动致癌易位,加速小鼠白血病的发生
作者为了评估这些circRNAs诱导全基因组DSBs的能力,通过单独或联合过表达circMLL(9,10)和circMLLT1(2)的稳定HL-60细胞系,采用中性彗星试验进行研究。结果表明,根据尾矩测量,与空载体相比,circMLL(9,10)、circMLL(9,10)/circMLLT1(2)和circMLLT1(2)细胞系的DSBs数量明显增加,其中circMLLT1(2)细胞与circMLL(9,10)表达系相比,增幅最小。紫外线照射HL-60 EV细胞作为阳性对照,显示出最大的尾矩(大约比EV高14倍)。对这些细胞系进行RNA测序,并使用STAR-fusion和clinker软件检测融合转录本,发现涉及MLL基因的染色体易位仅在circMLL(9,10)表达细胞系中可见。这些实验证明了circRNA驱动MLL重组体内精确的致癌易位。
接下来,作者通过空载体对照、单个circMLL(9,10)和circMLLT1(2),或双circRNA过表达(circMLL(9,10)/circMLLT1(2))细胞异种移植到免疫功能低下的NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ(NOD scid gamma)小鼠中,评估了circRNA过表达在体内的影响。Kaplan-Meier生存分析表明,与空载体对照相比,单独circRNA的过表达对这些小鼠的疾病发作没有显著影响;双过表达系显示出明显的疾病加速(p=0.04,log rank Mantel-Cox检验)。重要的是,作者使用MLL-MLLT1基因组DNA探针通过DNA-FISH证实,在circMLL(9,10)/circMLLT1(2)系中可以看到独特的融合。
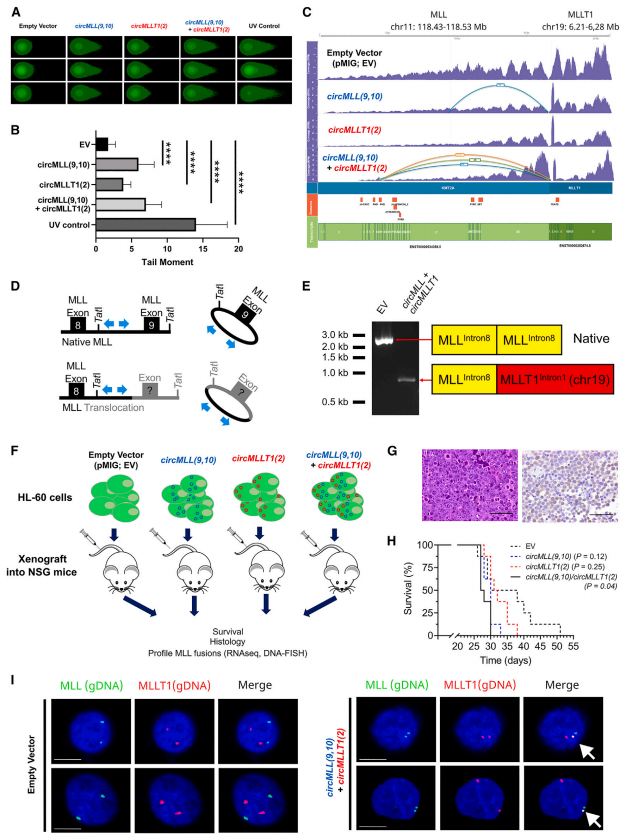 图5 circRNA驱动致癌染色体易位并加速白血病的发生
图5 circRNA驱动致癌染色体易位并加速白血病的发生
众所周知,AML是所有癌症中突变负担最低的,对AML的关注阐明了circRNAs在驱动这些常见且预后不佳的MLL易位中的致癌作用。而内源性RNA导致的DNA损伤(染色体易位)是驱动白血病的肿瘤发生和疾病侵袭性的体内证据。这代表了一种以前未知的、基于基因组失衡的肿瘤发生机制,其普遍性可能更加广泛,可能对更广泛地了解基因组突变至关重要,并可作为治疗的一个新靶标。
相关文章详看:
教科书或将重写:革命性研究发现体内癌症发生的新原因
原文链接:
https://doi.org/10.1016/j.ccell.2023.05.002

.png)
