胃癌(gastric cancer,GC)是严重影响人类健康的恶性肿瘤之一。国际癌症研究机构(International Agency for Research on Cancer,IARC)2020年的统计数据显示,每年新增GC患者超过100万人,GC的全球死亡率为7.7%。虽然近年来胃癌的诊治策略不断优化,但整体预后仍不尽理想。因此,迫切需要进一步探索GC的发病机制,以寻找有效的诊断和治疗靶点。
胰岛素样生长因子II mRNA结合蛋白3(Insulin like growth factor II mRNA binding protein 3,IGF2BP3)是RNA结合蛋白(RNA binding proteins,RBPs)中的一种,在包括GC在内的多种肿瘤中表达升高,且促进肿瘤的发生发展。机制上,IGF2BP3在肿瘤中通常与mRNA结合,进而影响mRNA的成熟、翻译和稳定性等发挥生物学功能。目前,IGF2BP3蛋白也逐渐被证实可以与非编码RNA相互作用影响肿瘤的进展。
环状RNA(circular RNAs,circRNAs)是非编码RNA重要的新成员,在真核生物中大量表达。研究发现,一些circRNAs已被证实在多种癌症的发生发展中起着重要的调控作用,具有潜在的临床应用价值。在GC中,有研究发现circRNAs可以与IGF2BP3蛋白结合而参与GC的进展[1,2]。然而,circRNAs是否直接调控GC中IGF2BP3的表达尚不清楚。因此,探索更多circRNA-IGF2BP3的作用方式,发现更多有功能的circRNA,对胃癌防治以及提高患者的生活质量具有重要的意义。
2023年6月20日,重庆医科大学药学院肖斌教授团队在《Journal of Translational Medicine》发表了题为“CircNFATC3 promotes the proliferation of gastric cancer through binding to IGF2BP3 and restricting its ubiquitination to enhance CCND1 mRNA stability”的研究论文。该研究揭示了一个新的circNFATC3-IGF2BP3-CCND1作用轴,促进胃癌细胞的增殖;也揭示了环状RNA与IGF2BP3互作的新模式,有可能成为新的GC治疗靶点。

一、胃癌细胞中与IGF2BP3蛋白结合的circRNA筛选及circNFATC3的鉴定和表达分析
1.1 目的circRNA的确定
通过RIP-seq,作者发现SGC7901细胞中根据与IGF2BP3蛋白结合的circRNAs的评分(Read number)排名前四的分别是circELK4、circARID1A、circFNDC3B和circNFATC3;其中,circELK4在16对胃癌组织和癌旁组织中表达无差异,而circARID1A、circFNDC3B和circNFATC3在胃癌组织中高表达;此外,circARID1A和circFNDC3B在GC中与IGF2BP3的相互作用已经有报道。因此,作者研究了GC中未报道的circNFATC3,并进一步评估其与IGF2BP3蛋白的相互作用。
1.2 CircNFATC3在GC细胞中的成环特性鉴定与定位检测
作者通过Sanger测序、gDNA和cDNA为模板的扩增实验、Oligo dT 实验、RNase R实验和放线菌素D实验,验证了circNFATC3是一个由亲本基因NFATC3的第2和3号外显子组成、没有5端帽结构和3端polyA尾、高稳定性的circRNA。核-质分离及RNA-FISH实验结果表明,circNFATC3主要定位在胃癌细胞的细胞质中。
1.3 CircNFATC3在胃癌组织中的表达分析
为了进一步检测circNFATC3在胃癌中的表达,作者利用胃癌组织芯片检测circNFATC3表达,结果表明CircNFATC3在胃癌组织中表达上调,且与肿瘤体积成正相关。
1.4 CircNFATC3与IGF2BP3蛋白的结合验证
作者通过RIP、RNA pull-down和RNA-FISH/IF实验验证了两者的结合关系。
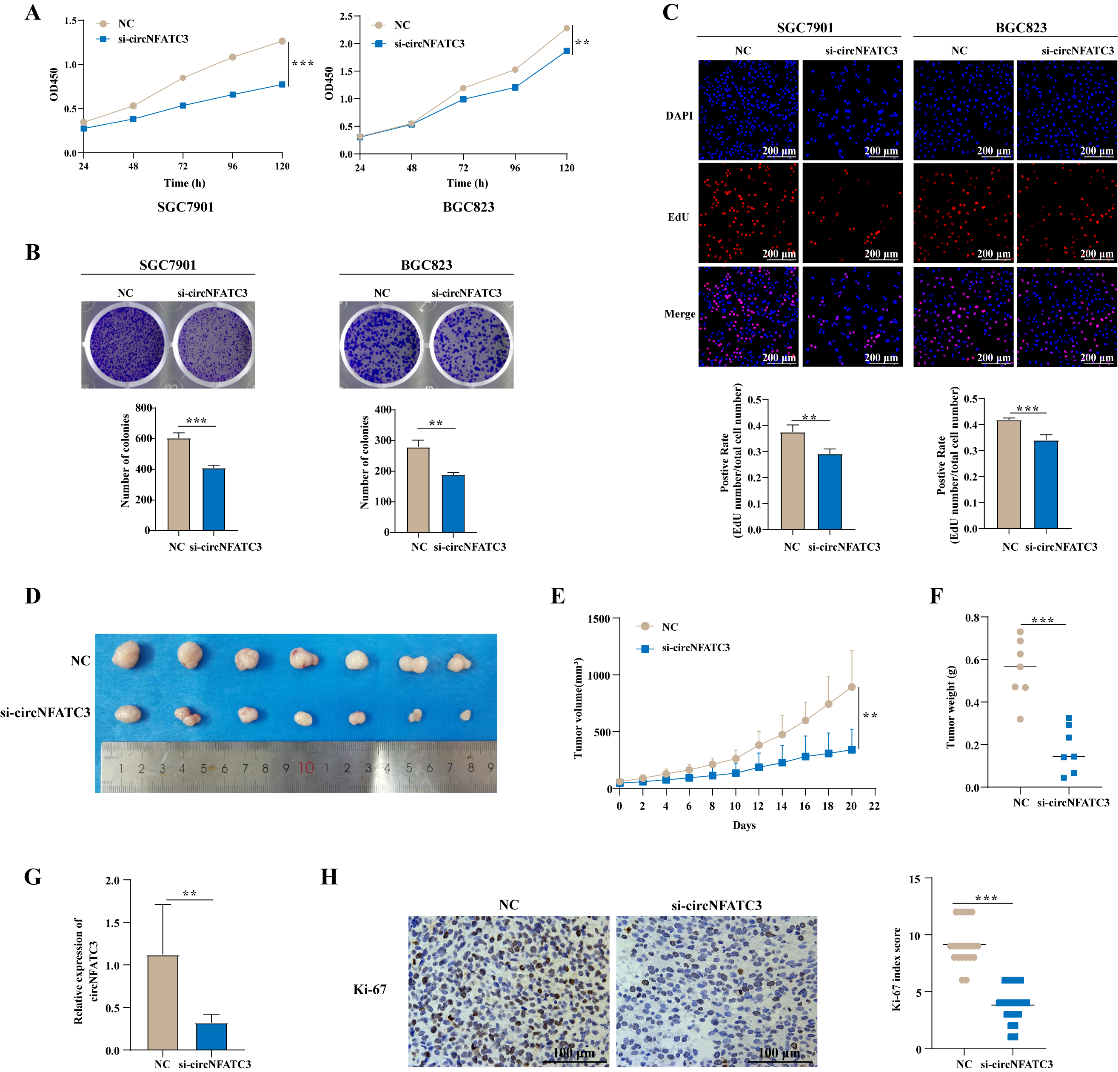
二、CircNFATC3在GC增殖中的功能探索
作者通过CCK8、平板克隆形成和EdU实验发现,干扰circNFATC3后SGC7901和BGC823细胞的增殖能力显著降低;并且,用胆固醇修饰的circNFATC3的siRNA瘤内注射基于HGC27细胞构建的裸鼠皮下移植瘤后,肿瘤生长明显减慢;且肿瘤组织中circNFATC3和Ki-67表达显著降低。以上结果表明,干扰circNFATC3后可以抑制胃癌细胞的的体内外增殖能力。
三、CircNFATC3促进胃癌增殖的机制研究
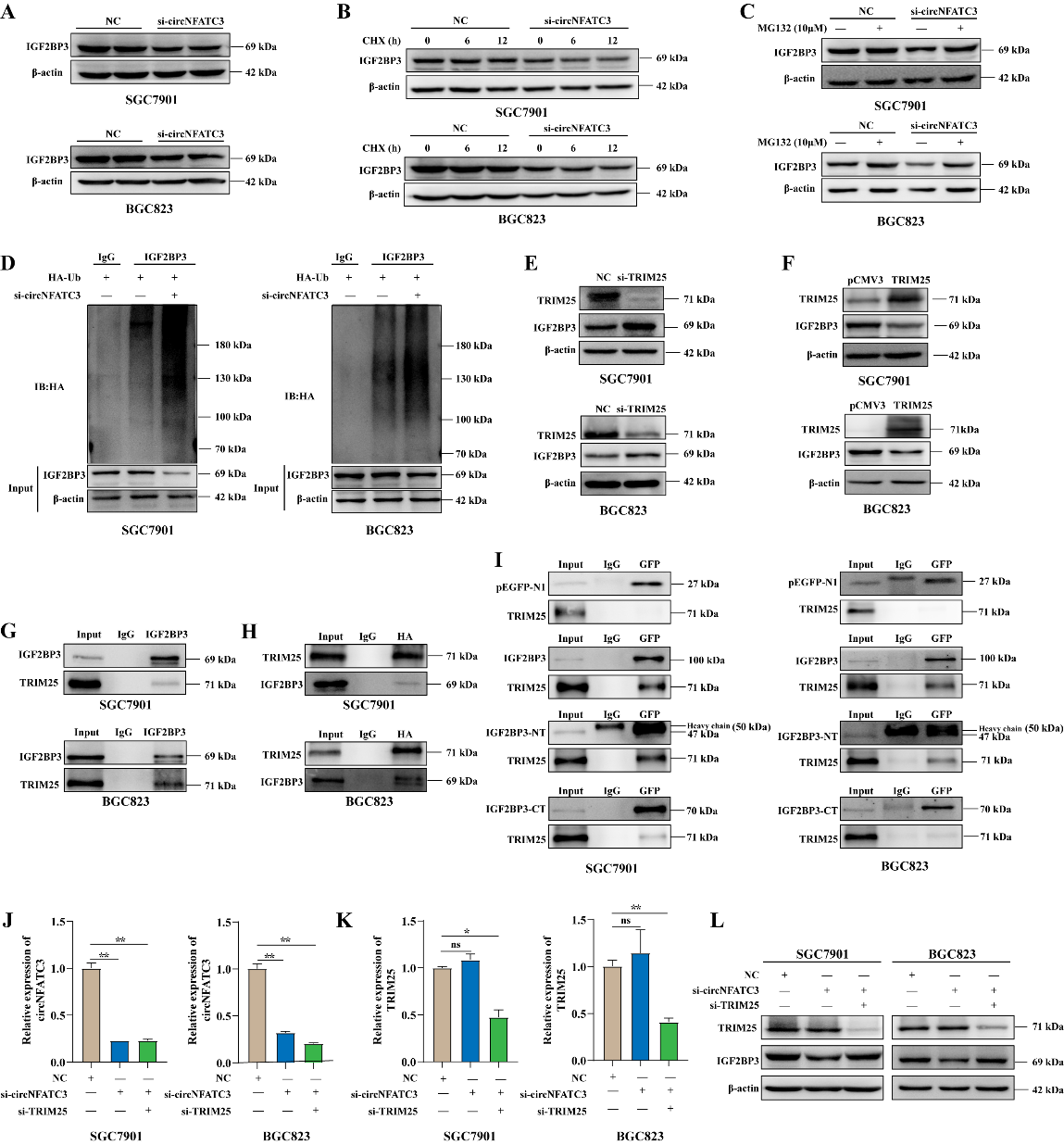
3.1 探索circNFATC3与IGF2BP3间的相互调控关系
作者已经证明了circNFATC3与IGF2BP3结合,但并不明确两者是否存在相互调控关系。因此,作者通过调控实验进一步去检测两者间的调控关系。实验发现,IGF2BP3不影响circNFATC3的表达;但干扰circNFATC3后,IGF2BP3蛋白表达而非mRNA表达显著下调。这些结果表明,circNFATC3可能在转录后调节IGF2BP3的表达。
3.2 探索circNFATC3调控IGF2BP3蛋白表达的分子机制
作者用CHX联合si-circNFATC3处理SGC7901和BGC823细胞发现,在两种细胞系敲低circNFATC3后,IGF2BP3蛋白的稳定性明显降低。这些结果表明,circNFATC3在GC中参与调控IGF2BP3蛋白降解。
自噬-溶酶体途径和泛素-蛋白酶体途径是细胞中蛋白质降解的两种主要机制。因此,作者评估了circNFATC3敲低是否会诱导GC细胞自噬。实验发现,自噬标记LC3A/B在circNFATC3敲低后没有显著改变;相比之下,蛋白酶体抑制剂MG132可以部分逆转SGC7901和BGC823细胞中circNFATC3敲低所致的IGF2BP3蛋白的下降。且在si-circNFATC3处理的细胞中,泛素修饰的IGF2BP3蛋白显著增强。这些结果表明,干扰circNFATC3可以通过泛素-蛋白酶体途径来降解IGF2BP3蛋白。
TRIM25是IGF2BP3的E3泛素连接酶[3],作者评估了TRIM25是否调节IGF2BP3在GC细胞中的表达。通过实验发现,TRIM25的反向调控IGF2BP3蛋白的表达。此外,通过IP实验验证了IGF2BP3蛋白和TRIM25蛋白的相互结合关系,且IGF2BP3蛋白截短突变体N端和C端都能直接与TRIM25蛋白相互作用。并且,作者发现敲低TRIM25可以挽救circNFATC3敲低导致的IGF2BP3下调。这些结果表明,TRIM25可能参与circNFATC3干扰引起的IGF2BP3蛋白降解。
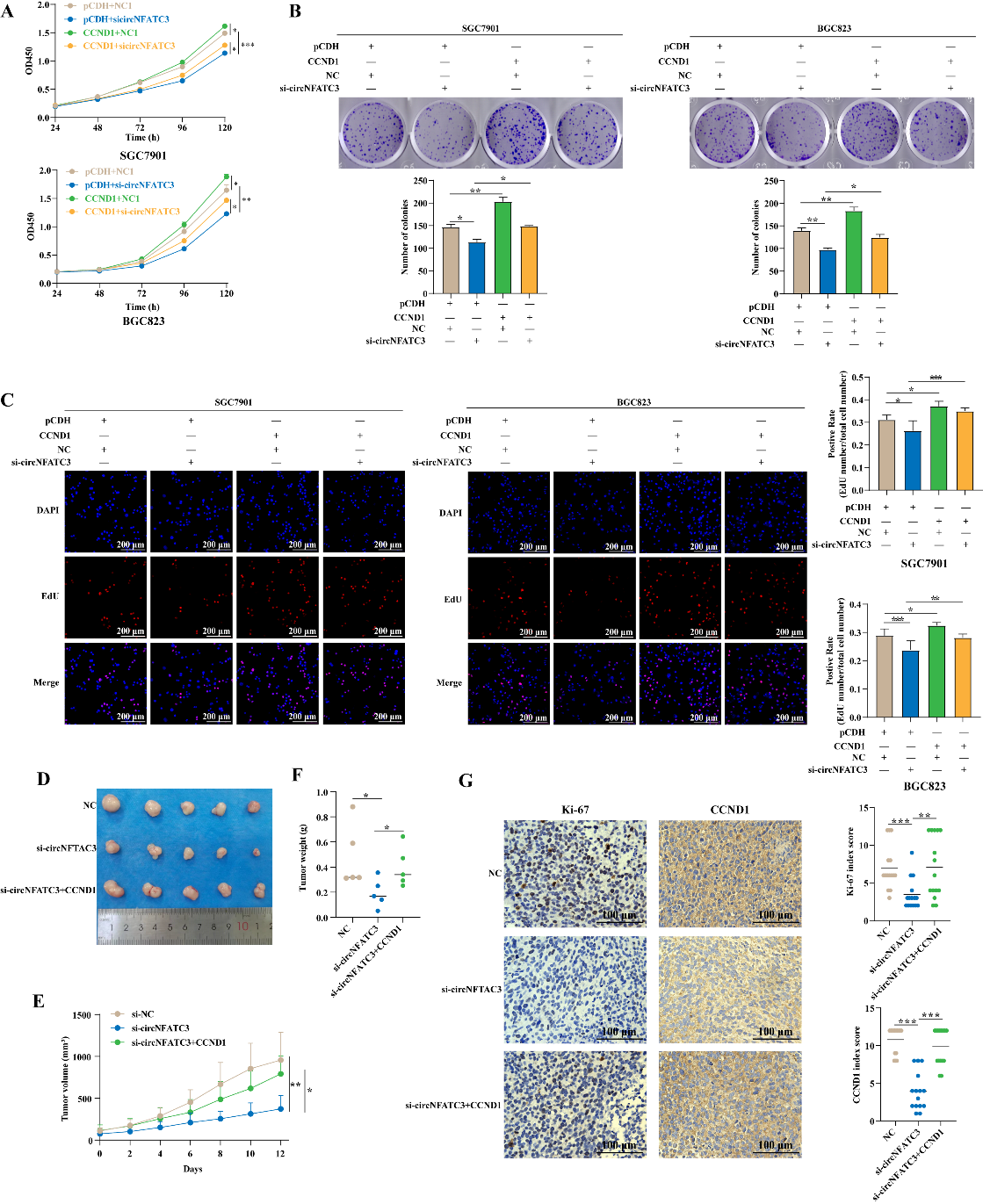
 3.3 探索circNFATC3-IGF2BP3轴对GC细胞增殖的影响
3.3 探索circNFATC3-IGF2BP3轴对GC细胞增殖的影响
作者通过体外回复实验发现,过表达IGF2BP3能够减弱si-circNFATC3对SGC7901和BGC823细胞增殖的抑制作用。
3.4 CircNFATC3与IGF2BP3下游靶基因的筛选及验证
为了更全面地研究IGF2BP3和circNFATC3的功能,作者进一步探索了两者共同调控的下游靶基因。首先,作者通过分析以下三个数据集:SGC7901细胞干扰IGF2BP3后进行转录组测序下调的mRNA、TCGA数据库中胃癌组织显著上调的mRNA(Log2(Fold Change)>2),以及RIP-seq技术筛选与IGF2BP3蛋白结合的mRNA。三者求取交集,作者发现RCC2、ARL6IP1、CCND1、KRT7和MUC13是circNFATC3和IGF2BP3的潜在靶基因。通过调控实验发现,CCND1是IGF2BP3和circNFATC3共同调控的靶基因。
IGF2BP3是一个RNA结合蛋白,机制上通常与mRNA结合后促进mRNA的稳定性而发挥功能[4-6]。为了验证IGF2BP3是否影响CCND1的mRNA稳定性,作者首先通过RIP实验检测IGF2BP3蛋白与CCND1的mRNA结合关系。其次,作者通过放线菌素D实验发现,circNFATC3与IGF2BP3蛋白能促进CCND1 mRNA稳定性。
3.5 CircNFATC3通过CCND1促进GC增殖的功能研究
通过实验,作者发现干扰CCND1能抑制GC细胞的增殖。并且,体内外回复实验表明,过表达CCND1可以部分回复si-circNFATC3引起的增殖抑制。这些结果表明,circNFATC3通过调节CCND1途径促进GC的增殖。
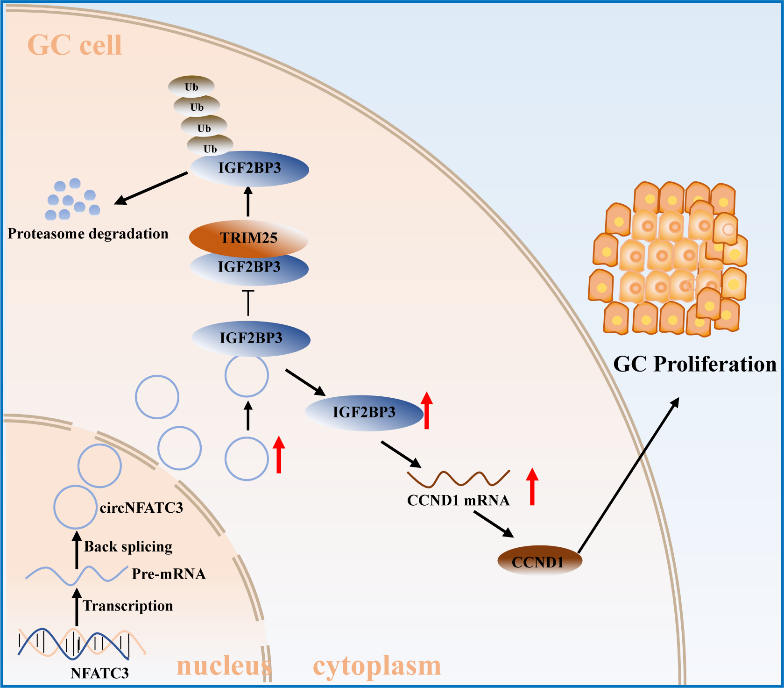
综上所述,circNFATC3是一个与IGF2BP3蛋白结合的circRNA,其在GC组织中的表达水平显著升高,且与肿瘤体积呈正相关。功能上,干扰circNFATC3表达会抑制GC细胞在体内外的增殖。机制上,circNFATC3可能通过抑制TRIM25介导的IGF2BP3蛋白泛素化,增强了IGF2BP3蛋白的稳定性,进而增强CCND1 mRNA的稳定性,促进了GC增殖。近年来,肖斌教授团队在环状RNA与IGF2BPs蛋白家族互作方面取得了一系列成果,证实环状RNA-IGF2BPs的作用方式复杂多样,可以通过竞争结合、协同促进、协同抑制等机制,影响下游基因的mRNA稳定性,调控肿瘤的增殖和转移(J Exp Clin Cancer Res.2022 Aug 19;41(1):251;Clin Transl Med.2022 Jul;12(7):e994;Mol Ther Nucleic Acids.2021.26:649-664)。本研究是对环状RNA-IGF2BPs互作方式的有力补充,证明环状RNA还能通过稳定IGF2BPs蛋白发挥促癌功能。总之,环状RNA-IGF2BPs的互作为肿瘤的治疗提供了新靶点。
原文链接:
https://translational-medicine.biomedcentral.com/articles/10.1186/s12967-023-04235-y
参考文献:
1. Yang Z, Wang T, Wu D, Min Z, Tan J, Yu B. RNA N6-methyladenosine reader IGF2BP3 regulates cell cycle and angiogenesis in colon cancer. J Exp Clin Cancer Res. 2020;39(1):203.
2. Hong Y, Qin H, Li Y, Zhang Y, Zhuang X, Liu L, et al. FNDC3B circular RNA promotes the migration and invasion of gastric cancer cells via the regulation of E-cadherin and CD44 expression. J Cell Physiol. 2019;234(11):19895-910.
3. Li B, Zhu L, Lu C, Wang C, Wang H, Jin H, et al. circNDUFB2 inhibits non-small cell lung cancer progression via destabilizing IGF2BPs and activating anti-tumor immunity. Nat Commun. 2021;12(1):295.
4. Wang X, Tian L, Li Y, Wang J, Yan B, Yang L, et al. RBM15 facilitates laryngeal squamous cell carcinoma progression by regulating TMBIM6 stability through IGF2BP3 dependent. J Exp Clin Cancer Res. 2021;40(1):80.
5. Wan W, Ao X, Chen Q, Yu Y, Ao L, Xing W, et al. METTL3/IGF2BP3 axis inhibits tumor immune surveillance by upregulating N(6)-methyladenosine modification of PD-L1 mRNA in breast cancer. Mol Cancer. 2022;21(1):60.
6. Huang GW, Chen QQ, Ma CC, Xie LH, Gu J. linc01305 promotes metastasis and proliferation of esophageal squamous cell carcinoma through interacting with IGF2BP2 and IGF2BP3 to stabilize HTR3A mRNA. Int J Biochem Cell Biol. 2021;136:106015.
.png)